Existem
diversas teorias para a origem da vida. Duas são as mais aceitas.
- Mítico/Religiosa- que defende a ideia de que Deus, ou Entidade(s) Divina(s) criou(arão) tudo que existe e conhecemos no mundo de hoje.
-

- Científica – defende o surgimento da
vida por meio de uma série de eventos e reações químicas.
Teoria do Big-Bang
Segundo
esta teoria o Universo surgiu de uma grande explosão. Surgiu a 13 bilhões de
anos.
O
nosso Sistema Solar surgiu da compactação de uma nebulosa a 9 bilhões de anos.
Os restos da nebulosa originaram os planetas.
Biogênese X Abiogênese
Abiogênese
– Da Antiguidade até pelo menos o início do século XVII, acreditava-se que seres pequenos como moscas, girinos e larvas, nasciam da matéria bruta.
Esta ideia foi primeiramente proposta por Aristóteles, onde os seres vivos poderiam surgir de
matéria inanimada. Como por exemplo de lama poderia nascer sapos, ou de lixo
poderia nascer ratos e baratas.
No
século XVII – surgiu a ideia religiosa, onde Deus criou os seres humanos e os
animais complexos (mamíferos e aves), os “mais” simples surgiriam
espontaneamente.
Biogênese
– surgiu no século XVII, defende a ideia de que um ser vivo surge somente a
partir de outro pré-existente.
Foi comprovada pelo médico italiano Francesco Redi, ao notar que pequenos "vermes" apareciam em lugares frequentados por moscas, tipo a carne em decomposição e assim supôs que estes "vermes surgiam de ovos provenientes das moscas adultas.
Contudo ao surgir o microscópio a ideia de geração espontânea ganhou força novamente e somente no século XIX com os experimentos de Louis
Pasteur enterraram definitivamente a teoria da abiogênese.
EXPERIMENTOS COMPROBATÓRIOS
·
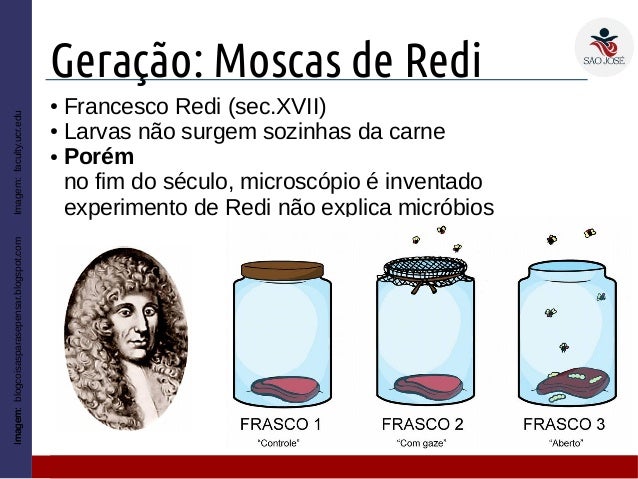
Francesco Redi – Francesco Redi realizou um
experimento que pôs a prova a teoria da abiogênese; em dois frascos colocou
restos de alimento, um tampou com gaze o outro não, assim constatou que somente
no aberto surgiam vermes.
A
partir do surgimento do microscópio voltou a ideia de abiogênese para o surgimento dos
microorganismos.
·
Louis Joblot – criou caldo nutritivo em
frascos, sendo alguns vedados e outros não, nos abertos surgiu microorganismos.
·
John Needham – repetiu o experimento e usou
cortiça para vedar os frascos em todos surgiram microorganismos.
·
Lazzaro Spallazani – criou caldo nutritivo e pôs em
frascos, vedou alguns com cortiça e outros hermeticamente, só nos de cortiça
surgiu vida.
·
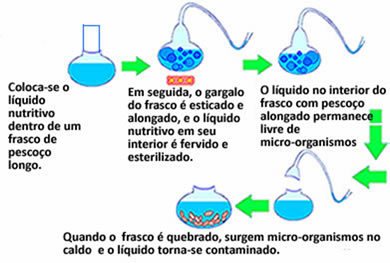
Louis Pasteur – Acabou de vez com a teoria da
abiogênese. Criou um caldo nutritivo e colocou em frascos, os quais entortou
seu gargalo formando um pescoço comprido e curvo (pescoço de cisne), assim
ficavam abertos e toda e qualquer poeira ficava retida no gargalo do frasco,
neste caldo não surgiu nenhum microorganismo, contudo quando quebrou o gargalo
dos frascos, surgiram microorganismos.
Teorias modernas sobre a origem
da vida
·
Teoria da Evolução Química – surgiram as primeiras moléculas
orgânicas (aminoácidos, açúcares, etc) que se uniram e formaram moléculas mais
complexas com estruturas capazes de autoduplicação. Para isso tinham água
líquida, moléculas orgânicas e fonte de energia para as reações químicas.
Terra primitiva – era quente e bombardeada por
meteoros que trouxeram elementos químicos (C, H, H2O, N). tinha
muita evaporação e precipitação.
Origem dos compostos orgânicos – segundo teorias, na Terra
primitiva existiam muitos gases como metano, amônia, hidrogênio e água, sem
mencionar as diversas descargas elétricas, muito calor e o acúmulo de água
líquida que com o passar do tempo sofreram reações entre si originando as
primeiras moléculas orgânicas que passaram a se separar do meio com uma
película de ar, como mantiveram a sua forma e se multiplicaram foram
considerados os primeiros seres
organismos vivos denominados coacervatos.
·
Experimentos de Miller – tentou reproduzir a Terra
primitiva e assim tentar criar moléculas orgânicas.
Hipótese heterotrófica
Os
primeiros seres vivos teriam surgido em mares repletos d moléculas orgânicas
que serviam de alimento e sua degradação em energia, era realizada por
fermentação, processo no qual não se usa gás oxigênio. Com o boom desses seres
houve uma escassez de alimento, que acabou gerando competição e selecionando os
seres mais adaptados às novas condições, provavelmente alguns tinham
desenvolvido a capacidade de converter em energia a luz solar, o que favoreceu
o surgimento de seres autótrofos.
Graças
a estes começou a surgir gás oxigênio na atmosfera o que permitiu uma melhora
na obtenção de energia, permitindo surgir os seres aeróbios.
Hipótese autotrófica
Os
primeiros seres vivos eram capazes de produzir moléculas utilizadas em sua
alimentação, acredita-se que realizavam por meio da quimiossíntese, que dizer que provavelmente utilizavam energia proveniente da oxidação de compostos inorgânicos para conseguirem produzir sua matéria
orgânica com base em água e gás carbônico.
FONTE:
SANTOS, Fernando Santiago dos; AGUILAR, João Batista Vicentin; OLIVEIRA, Maria Martha Argel de - SER PROTAGONISTA - Biologia 1. Ed. SM
AMABIS, José Mariano, MARTHO, Gilberto Rodrigues - BIOLOGIA volume 1. Ed. Moderna
IMAGENS OBTIDAS NA INTERNET
https://brasilescola.uol.com.br/biologia/hipotese-autotrofica.htm